
İçerik
Basitçe hesaplamaları için, kimyagerler bir reaksiyonda veya başka bir kimyasal işlemde yer alan belirli bir bileşiğin atomlarının sayısı için standart bir birim yarattı. Bir molü (mol), Avogadros sayısı olan (6.022 × 10 olan 12 gram karbon-12 ile aynı sayıda temel birime sahip herhangi bir maddenin miktarı olarak tanımlarlar.23). SI (metrik) ölçüm sistemi, bir milimetreyi (Mmol) bir molün binde biri olarak tanımlar. Genel olarak, elde ettiğiniz miktarı tartarak bir maddenin mol sayısını hesaplarsınız. Mmol'a dönüştürmek istiyorsanız, 10 ile çarpın3 (1,000).
TL; DR (Çok Uzun; Okumadı)
Bir mol, belirli bir bileşiğin Avogadros partikül sayısına eşittir. Bir milimol (Mmol) bir molün binde biri.
Mol Nasıl Hesaplanır?
Atomik kütleler, atomik kütle birimlerinde (AMU) ölçülür. Bir AMU, temelde bir karbon-12 atomunun çekirdeğinin kütlesinin tam 1 / 12'sidir. Bir maddenin bir molü, bu maddenin Avogadros sayısına eşittir. Bu tanıma göre, bir maddenin bir molünün gram cinsinden ağırlığı, AMU'daki bu maddenin ayrı bir partikülünün ağırlığı ile aynı sayıdır. Örneğin, karbon-12'nin atom ağırlığı, 12 AMU'dur, bu nedenle bir mol karbon-12, 12 gramdır.
Hidrojen dolu bir kabı düşünün (H)2). Kaptaki her parçacık iki hidrojen atomundan oluşan bir moleküldür, bu nedenle moleküler ağırlığı hesaplamak için yalnızca hidrojen atom kütlesini bilmeniz gerekir. Periyodik tablonun çoğu versiyonu, sembolün altındaki her bir elementin atom kütlesini listeler. Çekirdeğinde tek bir proton bulunan hidrojen için, doğal olarak oluşan tüm hidrojen izotoplarının ortalaması olan 1.008 AMU'dur. Sonuç olarak, hidrojen gazı atomik kütlesi 2.016 AMU'dur ve bir mol hidrojen gazı 2.016 gramdır. Numunenizdeki mol sayısını bulmak için numuneyi gram cinsinden tartınız ve bu ağırlığı gram cinsinden hidrojen gazının moleküler ağırlığı ile bölmelisiniz. Örneğin, 15 gram saf hidrojen gazı ağırlığında olan bir numune 7.44 mol içerir.
Mmol'a dönüştürme
Bazen incelenen miktarlar o kadar küçüktür ki, mol cinsinden onları ifade etmek zahmetlidir. Milimole girin. Mol sayısını bin ile çarparak, çok küçük bir sayıyı daha yönetilebilir bir sayıya dönüştürebilirsiniz. Bu, mililitre sırasındaki hacim birimleriyle çalışırken özellikle uygundur.
1 mol = 1.000 Mmol
Çözüm Konsantrasyonu
Kimyacılar, molariteyi, çözeltideki belirli bir bileşiğin konsantrasyonunun bir ölçüsü olarak kullanırlar. Molariteyi litre başına mol sayısı olarak tanımlarlar. Molariteyi milimolariteye, 1000 ile çarparak dönüştürürsünüz. Örneğin, 1 mol (molar, M olarak da yazılır) çözeltisi, litre başına 1 mol konsantrasyonuna sahiptir. Bu, litre başına 1.000 Mmol içeren 1000 Mmol (bazen mM olarak da yazılan millimolar) çözeltisine eşdeğerdir.
Örnek
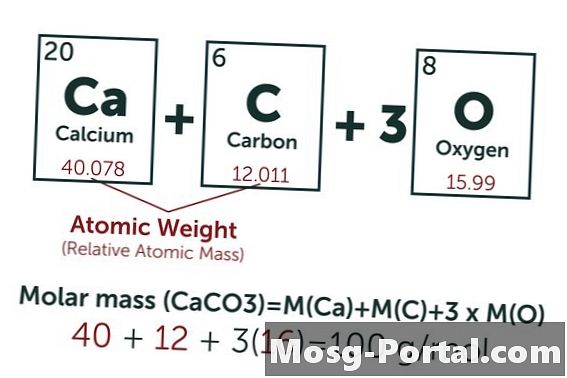
Bir çözelti, 0.15 gram kalsiyum karbonat içerir. Bu kaç milimol?
Kalsiyum karbonatın kimyasal formülü CaCO'dur.3. Karbon (C) atom ağırlığı yaklaşık 12 AMU, oksijen (O) yaklaşık 16 AMU ve kalsiyum (Ca) yaklaşık 40 AMU'dur. Böylece her kalsiyum karbonat molekülü 100 AMU ağırlığındadır, yani bir mol yaklaşık 100 gramdır. 0.15 gramlık bir ağırlık 0.15 gr, 100 gr / mol = 0.0015 mol'ü temsil eder. Bu, 1.5 Mmol'e eşittir.
2,5 litre çözelti içinde bu kadar kalsiyum karbonatın molaritesi ve milimolaritesi nedir?
Molarite litre başına mol sayısı olarak tanımlanır, bu nedenle molariteyi elde etmek için mol sayısını 2.5'e bölün: 0.0015 ÷ 2.5 =
0.0006 M
Millimolarity'i elde etmek için 1000 ile çarpın =
0.6 mM
Unutmayın, milimol sayısını çözelti hacmine bölerseniz millimolarite için aynı sonuca varırsınız.