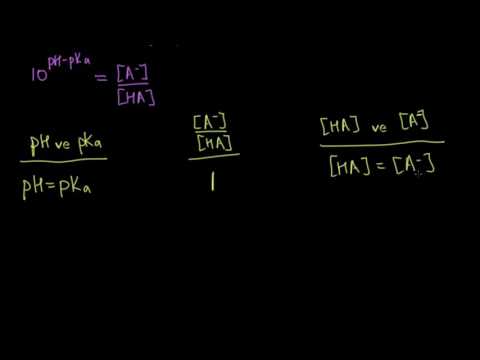
İçerik
pH ve pKa, asit-baz dengelerini içeren hesaplamalar da dahil olmak üzere kimyadaki birçok alanda önemli çözüm parametreleridir. pH, bir çözeltinin "hidrojen iyonu konsantrasyonunun" 10 bazında negatif logaritma olarak tanımlanan evrensel asitlik ölçüsüdür ve şöyle ifade edilir: pH = -log. Parantezler konsantrasyonu belirtir ve "+" işareti hidrojen iyonu yükünü belirtir. pKa, zayıf bir asidin "ayrışma sabiti" nin baz 10'a olan negatif logaritmasıdır. Örneğin, zayıf bir asit “HA” nın ayrışması şöyle yazılır: Ka = /, burada A- asidin “eşlenik bazı” dır. Bu nedenle, pKa = -log Ka. Her zayıf asitin kendine özgü bir pKa değeri vardır. Asidin pKa'sı bilindiğinde, zayıf bir asit ve konjugat bazı çözeltisi olan bir tampon çözeltisinin pH'sini hesaplamak için Henderson-Hasselbalch denklemini kullanın. Bu denklem ifade edilir: pH = pKa + log (/).
25.0 ml 0.1 M sodyum hidroksit (NaOH) çözeltisine 75.0 ml 0.1 M asetik asit çözeltisine (CH3COOH) eklenerek hazırlanan bir tampon çözeltisine sahip olduğunuzu varsayalım; Asetik asidin, aşağıdaki gibi konjugat baz CH3C00H- oluşturmak için NaOH ile reaksiyona girdiğine dikkat edin: CH3COOH + NaOH = CH3C00- + Na + H20. PH değerini hesaplamak için, reaksiyonu takiben tampon çözeltideki asit ve konjugat baz miktarlarını hesaplamak gerekir.
Tampon çözeltisindeki baz ve asit başlangıç mollerini hesaplayın. Örneğin, NaOH molleri = 25.0 ml x 0.1 mol / litre x 1 litre / 1000 ml = 0.0025 mol; CH3COOH molleri = 75.0 ml x 0.10 mol / litre x 1 litre / 1000 ml = 0.0075 mol.
Çözeltilerin karıştırılması üzerine, CH3COOH'un NaOH ile ilişkili OH- (hidroksil) iyonlarını tükettiğini, böylece kalan şeyin 0.0050 mol CH3COOH (asit), 0.0025 mol CH3COO- (baz) ve 0 mol OH- olduğunu unutmayın. .
Tampon çözeltisinin pH'sini hesaplamak için asidin pKa'sını (asetik asit için 4.74) ve asit ve baz konsantrasyonlarını Henderson-Hasselbalch denklemine yerleştirin. Örneğin, pH = 4.74 + log (0.0025 / 0.005) = 4.74 + log 0.5 = 4.44.