İçerik
- Paramanyetik ve Diamagnetic Elementler
- Bir Elemanın Paramanyetik mi, Diamagnetik mi olduğunu Hesaplamak
- Paramanyetik Atomların Listesi
- Paramanyetik Bileşikler
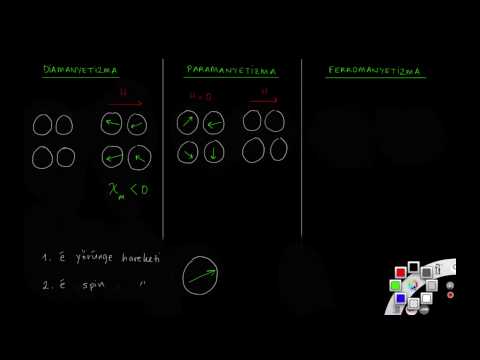
Tüm atomlar manyetik alanlara bir şekilde tepki verir, ancak çekirdeği saran atomların konfigürasyonuna bağlı olarak farklı tepki verirler. Bu konfigürasyona bağlı olarak, bir element diamagnetic, paramanyetik veya ferromanyetik olabilir. Diamagnetic olan elementler - aslında hepsi bir dereceye kadar - bir manyetik alan tarafından zayıf bir şekilde itilirken, paramanyetik elementler zayıf şekilde çekilir ve mıknatıslanabilir. Ferromanyetik malzemeler ayrıca mıknatıslanma kabiliyetine sahiptir, ancak paramanyetik elemanların aksine, mıknatıslanma kalıcıdır. Hem paramanyetizma hem de ferromanyetizma, diyamanyetizmadan daha güçlüdür, bu nedenle paramanyetizma ya da ferromanyetizma sergileyen öğeler artık diamagnetik değildir.
Oda sıcaklığında sadece birkaç element ferromanyetiktir. Bunlar arasında demir (Fe), nikel (Ni), kobalt (Co), gadolinyum (Gd) ve - yakın zamanda keşfedilen bilim adamları - rutenyum (Ru) bulunur. Manyetik bir alana maruz bırakarak bu metallerin herhangi birinde kalıcı bir mıknatıs yapabilirsiniz. Paramanyetik atomların listesi çok daha uzundur. Paramanyetik bir element, manyetik bir alan varlığında manyetik hale gelir, ancak siz alanı kaldırır çıkarmaz manyetik özelliklerini kaybeder. Bu davranışın nedeni, dış yörünge kabuğunda bir veya daha fazla eşleşmemiş elektronun varlığıdır.
Paramanyetik ve Diamagnetic Elementler
Bilimde son 200 yıldaki en önemli keşiflerden biri, elektrik ve manyetizma arasındaki bağlantıdır. Her atom negatif yüklü elektron bulutuna sahip olduğu için, manyetik özellikler için potansiyele sahiptir, ancak ferromanyetizma gösterip göstermediği, paramanyetizma mı yoksa diamagnetizmin konfigürasyonuna bağlıdır. Bunu takdir etmek için, elektronların hangi yörüngelerin çekirdeğin etrafında kalmaya karar verdiğine karar vermesi gerekir.
Elektronlar, dönüş dengesi olarak görselleştirebileceğiniz, bundan daha karmaşık olmasına rağmen, dönüş adı verilen bir kaliteye sahiptir. Elektronlar "döndürme" (saat yönünde döndürme olarak görselleştirebileceğiniz) veya "döndürme" (saatin tersi yönünde) içerebilir. Kabuk olarak adlandırılan çekirdeğin artan, kesin olarak tanımlanmış mesafeleri konusunda kendilerini düzenlerler ve her kabuğun içinde, her biri zıt bir dönüşe sahip olan ve en fazla iki elektron tarafından işgal edilebilecek ayrı sayıda yörüngeye sahip olan alt kabuklardır. Bir orbital işgal eden iki elektronun eşleştirildiği söylenir. Döndürmeleri iptal edilir ve net bir manyetik moment yaratmazlar. Diğer yandan, bir yörüngeyi işgal eden tek bir elektron eşleştirilmez ve net bir manyetik momentle sonuçlanır.
Diamagnetic elemanları, eşleştirilmemiş elektronları olmayanlardır. Bu elemanlar, bilim adamlarının, pirolitik grafit ya da kurbağa (evet, bir kurbağa!) Gibi bir çapa dayanan malzemeyi güçlü bir elektromıknatıs üzerinde kaldırarak gösterdikleri sık sık ortaya koydukları manyetik alana karşı çıkıyorlar. Paramanyetik elemanlar, eşleştirilmemiş elektronlara sahip olanlardır. Atomun net bir manyetik dipol momenti verir ve bir alan uygulandığında, atomlar alanla aynı hizadadır ve eleman manyetik hale gelir. Alanı kaldırdığınızda, termal enerji hizalamayı rasgele hale getirmek için müdahale eder ve manyetizma kaybolur.
Bir Elemanın Paramanyetik mi, Diamagnetik mi olduğunu Hesaplamak
Elektronlar çekirdek çevresindeki kabukları net enerjiyi en aza indirecek şekilde doldurur. Bilim adamları, bunu yaparken Aufbrau Prensibi, Hunds Kuralı ve Pauli Dışlama Prensibi olarak bilinen bu kurallara uyduklarını belirlediler. Bu kuralları uygulayarak kimyagerler, bir çekirdeği çevreleyen alt kabukların her birini kaç elektronun işgal ettiğini belirleyebilir.
Bir elementin diamagnetic veya paramanyetik olup olmadığını belirlemek için, sadece en dıştaki alt kabuğu işgal eden değerlik elektronlarına bakmak gerekir. En dıştaki alt kabuk eşleştirilmemiş elektronlu yörüngeler içeriyorsa, eleman paramanyetiktir. Aksi takdirde, diamagnetic. Bilim adamları alt kabuklarını s, p, d ve f olarak tanımlarlar. Elektron konfigürasyonunu yazarken, sözleşme değerlik elektronlarını periyodik tablodaki söz konusu elemandan önce gelen soy gazdan önce yapmaktır. Soy gazlar tamamen elektron yörüngelerini doldurdular, bu yüzden etkisiz kalıyorlar.
Örneğin, magnezyum (Mg) için elektron yapılandırması 3 saniyedir.2. En dıştaki alt kabuk iki elektron içerir, ancak bunlar eşlenmemişlerdir, bu nedenle magnezyum paramanyetiktir. Öte yandan, çinko elektron konfigürasyonu (Zn) 4s23 boyutlu10. Dış kabuğunda eşlenmemiş elektron yoktur, bu yüzden çinko diamagnetictir.
Paramanyetik Atomların Listesi
Elektron konfigürasyonlarını yazarak her bir elementin manyetik özelliklerini hesaplayabilirsiniz, ama neyse ki yapmak zorunda değilsiniz. Kimyacılar zaten bir paramanyetik elementler tablosu yarattılar. Bunlar aşağıdaki gibidir:
Paramanyetik Bileşikler
Atomlar bileşikler oluşturmak için birleştiğinde, bu bileşiklerin bazıları elementlerin yaptığı aynı nedenle paramanyetizma da gösterebilir. Bileşiklerin yörüngesinde bir veya daha fazla eşleşmemiş elektron varsa, bileşik paramanyetik olacaktır. Örnekler arasında moleküler oksijen (O2), demir oksit (FeO) ve nitrik oksit (NO). Oksijen durumunda, bu paramanyetizmayı güçlü bir elektromıknatıs kullanarak göstermek mümkündür. Böyle bir mıknatısın kutuplarının arasına sıvı oksijen dökerseniz, oksijen bir kutup gazı bulutu oluşturmak için buharlaşırken kutupların etrafında toplanacaktır. Sıvı azot (N2) Paramanyetik olmayan ve böyle bir bulut oluşmayacak.
Paramanyetik bir bileşikler listesi derlemek istiyorsanız, elektron yapılandırmalarını incelemeniz gerekir. Dış değerlikteki eşlenmemiş elektronları paramanyetik nitelikler kazandıran mermiler olduğundan, bu tür elektronlara sahip olan bileşikler liste yapar. Bu olsa, her zaman doğru değildir. Oksijen molekülü söz konusu olduğunda, çift değerli elektronlar vardır, ancak her biri, molekülün genel enerji durumunu en aza indirmek için daha düşük bir enerji durumundadır. Daha yüksek bir yörüngede bir elektron çifti yerine, alt yörüngelerde molekülü paramanyetik kılan iki eşleşmemiş elektron vardır.