İçerik
- İmmünoglobulinlerin Genel Özellikleri
- Sabit ve Değişken İmmünoglobulin Bölgelerinin İşlevleri
- IgA
- IgD
- IgE
- IgG
- IgM
- Antikor Çeşitliliği Üzerine Bir Not
Ayrıca antikorlar olarak da adlandırılan immünoglobulinler, genel olarak enfeksiyöz hastalık ve yabancı "istila" larla mücadeleden sorumlu olan bağışıklık sisteminin önemli bir kısmını oluşturan glikoprotein molekülleridir. Genellikle "Ig" olarak kısaltılmış antikorlar, kanda ve insanlarda ve diğer omurgalı hayvanlarda diğer vücut sıvılarında bulunur. Mikroplar (örneğin bakteriler, protozoan parazitler ve virüsler) gibi yabancı maddeleri tanımlamaya ve yok etmeye yardımcı olurlar.
İmmünglobülinler beş kategoriye ayrılır: IgA, IgD, IgE, IgG ve IgM. İnsan vücudunda sadece IgA, IgG ve IgM önemli miktarlarda bulunur, ancak bunların tümü insan bağışıklık yanıtına önemli veya potansiyel olarak önemli katkıda bulunur.
İmmünoglobulinlerin Genel Özellikleri
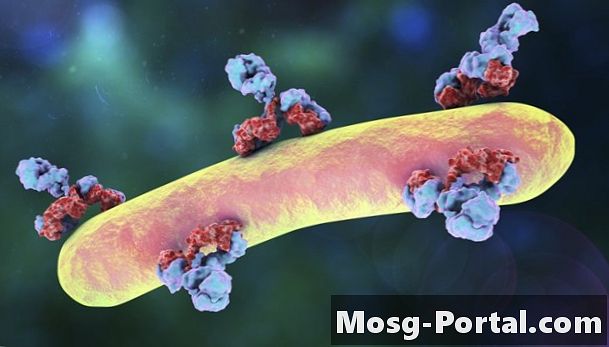
İmmünoglobulinler, lökosit sınıfı (beyaz kan hücreleri) olan B lenfositleri tarafından üretilir. İki uzun ağır (H) zincir ve iki kısa hafif (L) zincirden oluşan simetrik Y-şekilli moleküllerdir. Şematik olarak, Y'nin "gövdesi", immünoglobulin molekülünün tabanından tepesine yarıya kadar ayrılan ve kabaca 90 derecelik bir açıyla birbirinden ayrılan iki L zincirini içerir. İki L zinciri, Y'nin "kollarının" dış kısımları boyunca veya H zincirinin ayrılma noktasının üzerindeki kısımları boyunca uzanır. Böylece, hem gövde (iki H zinciri) hem de "kol" (bir H zinciri, bir L zinciri) iki paralel zincirden oluşur. L zincirleri iki tipte gelir: kappa ve lambda. Bu zincirlerin tümü, disülfit (S-S) bağları veya hidrojen bağları yoluyla birbirleriyle etkileşime girer.
İmmünoglobulinler ayrıca sabit (C) ve değişken (V) kısımlara ayrılabilir. C kısımları, tüm veya çoğu immünoglobülinlerin katıldığı aktiviteleri yönlendirirken, V alanları spesifik antijenlere bağlanır (yani, belirli bir bakteri, virüs veya başka bir yabancı molekül veya varlığın varlığını işaret eden proteinler). Antikorların "kolları" resmen Fab bölgeleri olarak adlandırılır, burada "Fab" "antijen bağlayıcı fragman" anlamına gelir; Bunun V kısmı, Fab bölgesinin Y dallanma noktasına en yakın olan Fab kollarının kısımları farklı antikorlar arasında oldukça sabit olduğundan ve her şeyin değil, Fab bölgesinin yalnızca ilk 110 amino asidini içerir. bölgesi.
Analoji yoluyla, anahtarın çalışması için tasarlanan belirli araçtan bağımsız olarak çoğu anahtar için ortak olan bir kısma sahip (örneğin, kullanırken elinizde tuttuğunuz kısım) ve sadece söz konusu araca özgüdür. Sap kısmı, bir antikorun C bileşenine ve özel kısmı V bileşenine benzetilebilir.
Sabit ve Değişken İmmünoglobulin Bölgelerinin İşlevleri
C bileşeninin Y dalının altındaki, Fc bölgesi olarak adlandırılan kısmı, antikor işleminin beyni olarak düşünülebilir. V bölgesi, belirli bir antikor türünde ne yapmak için tasarlanmış olursa olsun, C bölgesi, fonksiyonlarının yürütülmesini kontrol eder. IgG ve IgM'nin C bölgesi, iltihaplanma, fagositoz (içinde uzmanlaşmış hücrelerin fiziksel olarak yabancı cisimleri fiziksel olarak sardığı) ve hücre bozulmasını içeren spesifik olmayan bir "birinci savunma hattı" bağışıklık tepkileri kümesi olan tamamlayıcı yolunu aktive eden bölgedir. IgG'nin C bölgesi, bu fagositlere ve "doğal öldürücü" (NK) hücrelere bağlanır; IgE'nin C bölgesi mast hücrelerine, bazofillere ve eozinofillere bağlanır.
V bölgesinin özellikleri için, immünoglobulin molekülünün bu oldukça değişken şeridinin kendisi, hiperdeğişken ve çerçeve bölgelerine bölünmüştür. Sezginizin de belirttiği gibi, hiper-değişken sebeplerdeki çeşitlilik, immünoglobülinlerin kilitleme tarzında tanıyabilecekleri şaşırtıcı antijen yelpazesinden sorumludur.
IgA
IgA, insan sistemindeki antikorların yaklaşık yüzde 15'ini oluşturur ve ikinci en yaygın immünoglobülin çeşididir. Ancak kan serumu içinde sadece yüzde 6 oranında bulunur. Serumda, monomerik formunda bulunur - yani, yukarıda açıklandığı gibi bir Y şeklinde tek bir molekül olarak. Bununla birlikte, salgısında, bir dimer olarak ya da birbirine bağlanmış Y monomerlerinin ikisinde bulunur. Aslında, dimerik form daha yaygındır, çünkü IgA süt, tükürük, gözyaşı ve mukus gibi çok çeşitli biyolojik salgılarda görülür. Hedeflediği yabancı varlıkların cinsleri açısından spesifik değildir. Mukus zarlarındaki varlığı, fiziksel olarak savunmasız yerlerde veya mikropların vücuda daha derinden kolayca ulaşabileceği lekelerdeki önemli bir kapı bekçisi olmasını sağlar.
IgA beş günlük yarı ömre sahiptir. Salgı, Y monomerinden iki tane olmak üzere antijenleri bağlamak için toplam dört alan oluşturur. Bunlar, epitop bağlanma bölgeleri olarak adlandırılır, çünkü epitop, bir immün reaksiyonu tetikleyen herhangi bir istilacının spesifik bir kısmıdır. Yüksek seviyede sindirim enzimlerine maruz kalan mukozalarda bulunduğundan, IgA, bu enzimler tarafından parçalanmasını önleyen salgılayıcı bir bileşene sahiptir.
IgD
IgD, serum antikorlarının yaklaşık yüzde 0.2'sini veya yaklaşık 500'de 1'ini oluşturan beş immünoglobülin sınıfının en nadir görülenidir. Bir monomerdir ve iki epitop bağlama yerine sahiptir.
IgD, B-lenfositlerinin yüzeyine, bir B-hücresi reseptörü olarak (ayrıca sIg olarak adlandırılır) bağlanır, burada kan plazmasında dolaşan immünoglobülinlerden gelen sinyallere yanıt olarak B-lenfosit aktivasyonunu ve bastırılmasını kontrol ettiğine inanılır. IgD, kendi kendine reaktif oto-antikorlar üreterek B-lenfositlerin aktif olarak ortadan kaldırılmasında bir faktör olabilir. Antikorların kendilerini yapan hücrelere her zaman saldırması meraklı gibi görünse de, bazen bu eliminasyon aşırı zayıf veya yanlış yönlendirilmiş bir bağışıklık tepkisini kontrol edebilir veya hasar gördüğünde ve artık yararlı ürünler üretmediğinde B-hücrelerini havuzdan çıkarabilir.
Fiili bir hücre yüzeyi reseptörü olarak rolüne ek olarak, IgD'nin kanda ve lenf sıvısında daha az miktarda bulunur. Bazı insanlarda, penisilin üzerinde belirli haptenlerle (antijenik alt üniteler) reaksiyona girmesi düşünülmektedir, bu nedenle bazı insanlar bu antibiyotiğe alerjisi vardır; ayrıca normal, zararsız kan proteinleriyle de aynı şekilde reaksiyona girebilir ve böylece bir otoimmün tepkiye neden olabilir.
IgE
IgE serum antikorunun sadece yüzde 0.002'sini veya tüm dolaşımdaki immünoglobulinlerin yaklaşık 1 / 50.000'ini oluşturur. Bununla birlikte, immün cevapta hayati bir rol oynar.
IgD gibi, IgE bir monomerdir ve her "kol" üzerinde bir tane olmak üzere iki antijenik bağlanma yerine sahiptir. İki günlük kısa bir yarı ömre sahiptir. Kanda dolaşan mast hücrelerine ve bazofillere bağlanır. Bu nedenle, alerjik reaksiyonların bir aracısıdır. Bir antijen, bir mast hücresine bağlı bir IgE molekülünün Fab kısmına bağlandığında, bu, mast hücresinin, histamini kan dolaşımına salmasına neden olur. IgE ayrıca protozoan çeşidinin parazitlerinin parçalanmasında veya kimyasal bozulmasında da rol alır (amiplerin ve diğer tek hücreli veya çok hücreli istilacıların olduğunu düşünün). IgE ayrıca helmintlerin (parazitik kurtlar) ve bazı eklembacaklıların varlığına tepki olarak da yapılır.
Bazen IgE, diğer immün bileşenleri harekete geçirmek için galvanize ederek immün yanıtta dolaylı bir rol oynar. IgE, enflamasyonu başlatarak mukozal yüzeyleri koruyabilir. Ağrı ve şişmeye neden olma eğiliminde olduğundan, iltihaplanmanın istenmeyen bir şeyi ifade ettiğini düşünebilirsiniz. Ancak, diğer immün yararlarının yanı sıra iltihaplanma, tamamlayıcı yollardan protein olan IgG'yi ve beyaz kan hücrelerinin istilacılarla yüzleşmek için dokulara girmesini sağlar.
IgG
IgG, insan vücudundaki baskın antikordur ve tüm immünoglobulinlerin yüzde 85'ini oluşturur. Bunun bir kısmı, söz konusu IgG alt sınıfına bağlı olarak uzun, değişken olmasına rağmen, yedi ila 23 günlük yarı ömrüdür.
Beş immünoglobülin tipinden üçünde olduğu gibi, IgG bir monomer olarak mevcuttur. Başta kanda ve lenfte bulunur. Hamile kadınlarda plasentadan geçme yeteneği vardır, doğmamış fetüsü ve yenidoğan bebeği korur. Başlıca faaliyetleri arasında makrofajlarda (uzman "yiyen hücreler") ve nötrofillerde (başka bir tür beyaz kan hücresi) fagositozun arttırılması; nötralize edici toksinler; ve virüslerin etkisiz hale getirilmesi ve bakterilerin öldürülmesi. Bu, IgG'ye, sistemde çok yaygın olan bir antikora uyan geniş bir fonksiyon paleti verir. IgM'yi yakından takip eden bir istilacı olduğunda olay yerindeki ikinci antikordur. Vücudun anamnestetik tepkisi içinde varlığı oldukça artmıştır. “Anamnestic” “unutma” anlamına gelir ve IgM daha önce karşılaştığı bir istilacıya sayıları hemen yükselir. Son olarak, IgG'nin Fc kısmı, istilacı mikropların etkilerini öldürebilen veya sınırlandırabilen, ADG'ye bağlı, antikora bağımlı hücre aracılı sitotoksisite veya ADCC'yi harekete geçirmek için NK hücrelerine bağlanabilir.
IgM
IgM, immünoglobulinlerin colossus'udur. Bir pentametre veya beş bağlı IgM monomerinden oluşan bir grup olarak bulunur. IgM'nin kısa bir yarı ömrü (yaklaşık beş gün) vardır ve yaklaşık yüzde 13 ila 15 serum antikoru oluşturur. Önemli olarak, aynı zamanda, tipik bir immünolojik cevap sırasında yapılan ilk immünoglobulin olan dört antikor kardeşi arasında birinci savunma hattıdır.
IgM bir pentamer olduğundan, sert bir rakip haline getiren 10 epitop bağlanma yerine sahiptir. Diğer birçok immünoglobülininkiler gibi beş Fc kısmı, tamamlayıcı-protein yolunu aktive edebilir ve "ilk cevaplayıcı" olarak, bu konuda en etkili antikor türüdür. IgM istilacı maddeyi aglutinize eder, bireysel parçaları vücuttan daha kolay temizlenebilmesi için birbirine yapışmaya zorlar. Aynı zamanda mikroorganizmaların parçalanma ve fagositozunu, bakterileri yok etmede özel bir afinite ile teşvik eder.
IgM'nin monomerik formları mevcuttur ve esas olarak reseptörler veya sIg olarak B lenfositlerin yüzeyinde bulunur (IgD'de olduğu gibi). İlginç bir şekilde, vücut zaten dokuz aylıkken yetişkin IgM seviyeleri üretti.
Antikor Çeşitliliği Üzerine Bir Not
Beş immünoglobülinin her birinin Fab bileşeninin hiperdeğişken kısmının çok yüksek değişkenliği sayesinde, beş biçimsel sınıf boyunca astronomik bir dizi benzersiz antikor oluşturulabilir. Bu, L ve H zincirlerinin aynı zamanda birkaç izotip veya yüzeysel olarak aynı düzende olan, ancak farklı amino asitler içeren zincirlerle gelmesi gerçeğiyle de artar. Aslında, üç milyondan fazla eşsiz gen kombinasyonu üreten, toplam 177 için 45 farklı "kappa" L zincir geni, 34 "lambda" L zincir genleri ve toplam 177 için 90 H zincir genleri vardır.
Bu, evrim ve hayatta kalma açısından anlamlıdır. Bağışıklık sistemi sadece zaten bildiği istilacılarla yüzleşmek için hazırlanmalı, aynı zamanda hiç görmediği istilacılara ya da bu konuda, doğada yepyeni olanlara en uygun yanıtı oluşturmak için de hazırlanmalıdır. Mutasyonlar yoluyla kendilerini geliştirmiş influenza virüsleri olarak. Zamanla ve mikrobiyal ve omurgalı türler arasında konakçı istilacı etkileşimi, devam eden, iç içe geçmiş bir "silahlanma yarışından" öte değildir.