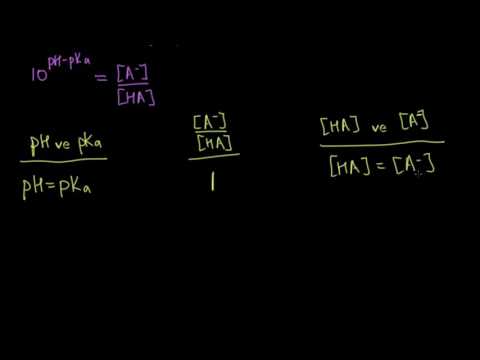
Bir titrasyon, bir cam tüp (büret) ve bir beher kullanarak bir maddeyi diğerine "titre" olarak bıraktığınız bir kimya deneyidir. Bir asit-baz titrasyonunda, bir baz "eşdeğerlik noktasına" veya pH 7 olan nötr bir çözeltiye ulaşıncaya kadar bir asit içine titre edersiniz. az miktarda asit eklediğinizde, pH'daki değişimlere direnç gösterir. Asitinizin ayrılma derecesini temsil edebilir - ve böylece "pKa" değerini kullanarak çözeltilerin pH'ını değiştirebilir ve bu değeri titrasyon denemenizdeki verileri kullanarak hesaplayabilirsiniz.
Eşitlik noktasından önce titrasyon eğrinizde bir nokta seçin ve eğrinin dikey koordinatı olan pH değerini kaydedin. Örnek olarak, pH 5,3 olan bir noktada bir çözeltiyi analiz ettiğinizi varsayalım.
Bu noktada asidin konjugat bazına oranını belirleyin, eşdeğerlik noktasına ulaşmak için eklemeniz gereken hacmi göz önünde bulundurun. Denklik noktasına ulaşmak için 40 mL eklemeniz gerektiğini varsayalım. Eğer pH 5.3 olduğunda, 10 mL eklediyseniz, denklik noktasına giden yolun dörtte biri olduğunuz anlamına gelir. Başka bir deyişle, asidin dörtte üçünün hala nötralize edilmesi gerekir ve asitler birleşik baz bu noktada çözeltinin dörtte birini oluşturur.
Değerlerinizi Henderson-Hasselbalch denklemine (pH = pKa + log (/)) ekleyin, burada konjugat bazının konsantrasyonu ve konjugat asidinin konsantrasyonu. Titrants hacminin bir fonksiyonu olarak ölçülen pH'ı seçtiğinizden, sadece konjugat bazın aside oranını bilmeniz gerektiğini unutmayın. Örnek çözeltinin pH değeri 5.3 olduğunda, bu (1/4) / (3/4) veya 1/3: 5.3 = pKa + log (1/3) = pKa + -48 idi; yani 5.3 + .48 = pKa + -.48 + .48 veya pKa = 5.78.