İçerik
Tüm elemanlar izotoplardır. Belirli bir elementin tüm atomları aynı atom numarasına (proton sayısına) sahip olsa da, atom ağırlığı (birlikte proton ve nötron sayısı) değişmektedir. "İzotop" terimi, atom ağırlığındaki bu değişimi ifade eder - aynı sayıda protona sahip iki atom ve farklı sayıda nötron, aynı elemanın iki izotopudur.
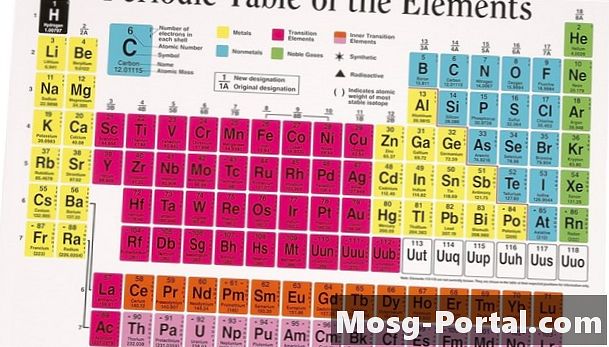
Atomik numara
Protonlar, bir atom çekirdeğinde pozitif yüklü parçacıklardır. Bir atom bir bütün olarak nötr bir yük taşır, böylece her pozitif yüklü proton negatif yüklü bir parçacık ile dengelenir. Bu negatif parçacıklar - elektronlar - çekirdeğin dışında yörünge. Elektronların yörüngesel konfigürasyonu, bir atomun diğer kimyasallara nasıl tepki vereceğini ve bağlanacağını belirler ve her bir elemente kendine özgü kimyasal ve fiziksel özelliklerini verir. Her bir eleman, periyodik tablodaki kimyasal kısaltmanın üzerinde benzersiz bir atom numarasına sahiptir.
Atom ağırlığı
Nötronlar, ücretsiz atom altı atomik partiküllerdir, bu yüzden atom çekirdeğindeki nötron sayısı, elektron sayısını veya orbital konfigürasyonunu etkilemez. Aynı sayıda proton ve farklı sayıda nötron bulunan iki atom aynı fiziksel ve kimyasal özelliklere sahip olacak, ancak farklı atomik ağırlıklara sahip olacaktır. Bu iki atom aynı elemanın farklı izotoplarıdır. Örneğin, en yaygın hidrojen izotopu H-1'dir, yani atom bir protona sahiptir ve nötron içermez, ancak H-2 ve H-3 izotopları da sırasıyla bir ve iki nötronla mevcuttur. Periyodik tablo, elementlerin kimyasal sembolünün altındaki elementlere ortalama atomik ağırlık verir.
Radyoaktif İzotoplar
Bir atomun daha ağır izotopları genellikle kararsızdır ve zaman içinde daha hafif izotoplara bölünür. Bu atomik bozulma, alfa, beta ve gama ışıması şeklinde enerji açığa çıkarır. Hidrojen-3, örneğin, radyoaktifdir ve hidrojen-2'ye parçalanır. Tüm elemanların değişen oranlarda çürüyen radyoaktif izotopları vardır. Çürüme oranı yarı ömürlerde ölçülür - belirli bir elementin örneğinde radyoaktif izotopların yarısı için daha hafif izotoplara dönüşmek için geçen süre. Hidrojen-3 için yarı ömür 12.32 yıldır.
Radyoaktif İzotopların Kullanım Alanları
Araştırmacılar ve tıp uzmanları, radyoaktif izotopları geniş ölçüde kullanır. Doğal olarak oluşan radyoaktif izotop karbon-14 miktarını ölçerek, arkeologlar ve paleontologlar bir fosilin veya eserin yaklaşık yaşını belirleyebilirler. Doktorlar, kalp problemlerini, beyin tümörlerini ve diğer anormallikleri tespit etmek için radyoaktif izleyiciler olarak iyot-131 ve baryum-137 izotoplarını kullanır ve kobalt-60, kanser tümörlerinin gelişimini durdurmak için bir radyasyon kaynağı olarak görev yapar.