İçerik
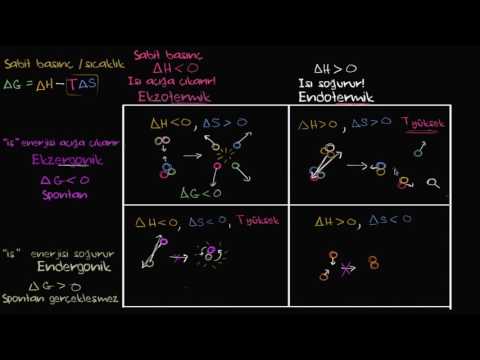
Kimyasal bir tepkimede, tepkenler adı verilen başlangıç malzemeleri ürünlere dönüştürülür. Tüm kimyasal reaksiyonlar, aktivasyon enerjisi olarak adlandırılan bir başlangıç enerji girişi gerektirse de, bazı reaksiyonlar, çevreye net bir enerji salınımına neden olur ve diğerleri, çevreden net bir enerji emilimine yol açar. İkinci duruma endergonik reaksiyon denir.
Reaksiyon Enerjisi
Kimyacılar reaksiyon kabını "sistem" ve evrendeki her şeyi "çevre" olarak tanımlarlar. Bu nedenle, bir endergonik reaksiyon çevreden enerji emdiğinde, sisteme enerji girer. Karşıt tip, enerjinin çevreye salındığı ekzonomik bir reaksiyondur.
Herhangi bir reaksiyonun ilk kısmı, reaksiyon tipi ne olursa olsun, daima enerji gerektirir. Yanan odun ısı yayar ve kendiliğinden bir kez başladıktan sonra kendiliğinden meydana gelse de, işlemi enerji ekleyerek başlatmanız gerekir. Odun yakmaya başlamak için eklediğiniz alev, aktivasyon enerjisi sağlar.
Aktivasyon Enerjisi
Reaktif taraftan kimyasal denklemin ürün tarafına geçmek için, aktivasyon enerji bariyerini aşmanız gerekir. Her bireysel reaksiyonun karakteristik bir bariyer boyutu vardır. Bariyerin tepkimesinin endergonik mi yoksa ekzonomik mi olduğu ile ilgisi yoktur; örneğin, ekzonomik bir reaksiyon çok yüksek bir aktivasyon enerji bariyerine sahip olabilir veya bunun tersi olabilir.
Bazı reaksiyonlar birçok aşamada gerçekleşir ve her adım üstesinden gelmek için kendi aktivasyon enerji bariyerine sahiptir.
Örnekler
Sentetik reaksiyonlar endergonik olma eğilimindedir ve molekülleri parçalayan reaksiyonlar eksergonik olma eğilimindedir. Örneğin, bir protein yapmak için katılan amino asitlerin işlemi ve fotosentez sırasında karbondioksitten glikoz oluşumu hem endergonik reaksiyonlardır. Bu, daha büyük yapılar inşa eden işlemlerin enerji gerektirmesi muhtemel olduğu için anlamlıdır. Tersine reaksiyon - örneğin, glikozun karbondioksit ve suya hücresel olarak solunması - exergonic bir işlemdir.
Katalizörler
Katalizörler bir reaksiyonun aktivasyon enerji bariyerini azaltabilir. Bunu, reaktan ve ürün moleküllerinin arasında bulunan ara yapıyı stabilize ederek dönüşümünü kolaylaştırarak yaparlar. Temel olarak, katalizör reaktiflere geçmesi için daha düşük enerjili bir "tünel" verir ve böylece aktivasyon enerji bariyerinin ürün tarafına geçmesini kolaylaştırır. Pek çok katalizör türü vardır, ancak en iyi bilinenlerden bazıları biyoloji dünyasının katalizörleri olan enzimlerdir.
Reaksiyon Kendiliğindenliği
Aktivasyon enerji bariyerinden bağımsız olarak, yalnızca ekzonomik reaksiyonlar kendiliğinden meydana gelir, çünkü enerji verirler. Yine de, her ikimiz de endergonik süreç olan kaslarımızı inşa etmemiz ve vücudumuzu onarmamız gerekiyor. Endergonik bir işlemi, reaktifler ve ürünler arasındaki enerji farkına uyması için yeterli enerji sağlayan ekzonomik bir işlemle birleştirerek sürdürebiliriz.