İçerik
Birçok bileşik, elektromanyetik spektrumun görünür veya ultraviyole kısmında ışığı emer. Beers yasasını kullanarak, ne kadar ışığını emdiğine bağlı olarak bir çözümün konsantrasyonunu hesaplayabilirsiniz.
Bira Yasasını Kullanma
Bira yasası, absorbe edilen radyasyon miktarını düzenler ve absorbansın konsantrasyon ile doğrudan orantılı olduğunu gösterir. Dolayısıyla, belirli bir çözücü içinde çözünen bir bileşiğin konsantrasyonu arttıkça, çözeltinin emiciliği de orantılı olarak artmalıdır. Kimyacılar, bilinmeyen çözeltilerin konsantrasyonunu belirlemek için bu ilişkiden yararlanır. Bu, ilk önce standart çözeltiler adı verilen ve bilinen konsantrasyondaki çözeltiler üzerindeki absorbans verilerini gerektirir. Absorbans ve konsantrasyon verileri daha sonra matematiksel ilişkilerini kurmak için bir kalibrasyon eğrisinde çizilir. Bilinmeyen numunenin konsantrasyonu, absorbansı ölçülerek belirlenebilir.
Çözüm Konsantrasyonunu Hesaplamak
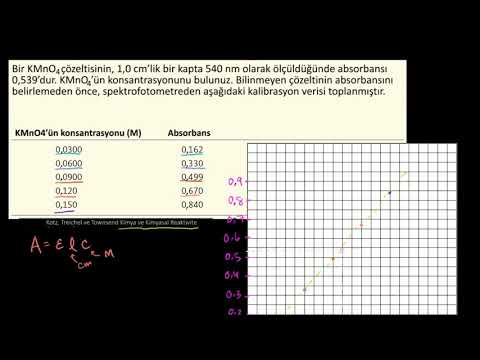
Aşama 1. Standart çözeltiler için y ekseni üzerinde absorbans ve x ekseni üzerinde konsantrasyon kalibrasyon arsa oluşturun. Veri noktaları oldukça düz bir çizgi boyunca düşmelidir. İki veri noktası mutlak asgari değeri temsil eder ve daha fazlası daha iyidir.
Adım 2. Veri noktalarından "en uygun" düz bir çizgi çizin ve çizgiyi y ekseniyle kesişecek şekilde uzatın. Satırda veri noktaları değil, iki rastgele nokta seçin ve x ve y koordinatlarını belirleyin. Bu koordinatları (x1, y1) ve (x2, y2) olarak etiketleyin.
Aşama 3. Çizginin m m eğimini (m = (y1 - y2) / (x1 - x2) formülüne göre hesaplayın. Çizginin y eksenini geçtiği y değerini not alarak b kısaltılmış y-kesişimini belirleyin. Örneğin, koordinattaki (0.050, 0.105) ve (0.525, 0.315) satırındaki iki rastgele nokta için eğim şöyledir:
m = (0,105-0,315) / (0,050-0,525) = 0,440.
Eğer çizgi y eksenini 0.08'de geçerse, o zaman bu değer y-kesişimini temsil eder.
4. adım Kalibrasyon grafiğinin hattının formülünü y = mx + b şeklinde yazın. 3. Adımdaki örneğe devam edersek, denklem y = 0.440x + 0.080 olur. Bu, kalibrasyon eğrisinin denklemini temsil eder.
Adım 5. Bilinmeyen konsantrasyonun çözeltisinin y olarak belirlenen denklemde absorbansını değiştirin ve x'in konsantrasyonunu temsil ettiği x için çözün. Örneğin, bilinmeyen bir çözelti, 0.330'luk bir absorbans gösterirse, denklem aşağıdakileri sağlar:
x = (y - 0.080) / 0.440 = (0.330 - 0.080) / 0.440 = litre başına 0.568 mol.
Teori Vs. Uygulama
Beer kanunu emilim ve konsantrasyonun doğrudan orantılı olduğunu belirtse de, deneysel olarak bu sadece dar konsantrasyon aralıklarında ve seyreltik çözeltilerde geçerlidir. Böylece, konsantrasyonda, örneğin litre başına 0.010 ila 0.100 mol arasında değişen standart çözeltiler doğrusallık sergileyecektir. Bununla birlikte, litre başına 0.010 ila 1.00 mol'lük bir konsantrasyon aralığı muhtemelen değişmeyecektir.