İçerik
Büyük olasılıkla, okulda okuduğunuz ilk kimyasal reaksiyonlar bir yönde hareket etti; örneğin, sirke "volkan" yapmak için kabartma tozu içerisine dökülür. Gerçekte, reaksiyonların çoğu, her iki yöne işaret eden bir ok ile gösterilmelidir, bu da reaksiyonun her iki yöne de gidebileceği anlamına gelir. Gibbs'in bir sistemin serbest enerjisini tespit etmek, bir okun diğerinden çok daha büyük olup olmadığını belirlemenin bir yolunu sunar; yani reaksiyon hemen hemen her zaman bir yöne mi gidiyor, yoksa ikisi de aynı boyda mı? İkinci durumda, reaksiyonun diğerinden bir şekilde gitmesi muhtemeldir. Gibbs serbest enerjisinin hesaplanmasındaki üç kritik faktör entalpi, entropi ve sıcaklıktır.
toplu ısı
Entalpi, bir sistemde ne kadar enerji bulunduğunun bir ölçüsüdür. Entalpi'nin birincil bir bileşeni iç enerjidir veya moleküllerin rasgele hareketinden elde edilen enerjidir. Entalpi, ne moleküler bağların potansiyel enerjisi ne de hareketli bir sistemin kinetik enerjisidir. Bir katıdaki moleküller bir gazınkinden çok daha az hareket eder, bu yüzden katı daha az entalpi olur. Entalpi hesaplanmasındaki diğer faktörler, bir gaz sisteminde en önemli olan sistemin basıncı ve hacmidir. Bir sistem üzerinde çalışırken veya ısı ve / veya madde eklediğinizde veya çıkardığınızda entalpi değişir.
Entropi
Entropiyi, bir sistemin termal enerjisinin bir ölçüsü veya sistemin düzensizliğinin bir ölçüsü olarak düşünebilirsiniz. İkisinin nasıl ilişkili olduğunu görmek için donmuş bir bardak su düşünün. Isı enerjisini sudan uzaklaştırdığınızda, serbest ve rasgele hareket eden moleküller sağlam ve çok düzenli bir buz kristalinde kilitlenir. Bu durumda, sistem için entropi değişikliği negatifti; daha az düzensizleşmişti. Evren düzeyinde, entropi her zaman artmaktadır.
Sıcaklıkla İlişki
Entalpi ve entropi sıcaklıktan etkilenir. Sisteme ısı eklerseniz, hem entropiyi hem de entalpi arttırırsınız. Sıcaklık ayrıca Gibbs serbest enerjisinin hesaplanmasında bağımsız bir faktör olarak dahil edilir. Gibbs serbest enerjisindeki değişimi, sıcaklığı entropi değişikliğiyle çarparak ve ürünü, entalpi sistemindeki değişimden çıkartarak hesaplarsınız. Bundan, sıcaklığın Gibbs serbest enerjisini önemli ölçüde değiştirebileceğini görebilirsiniz.
Kimyasal Reaksiyonlarda Alaka
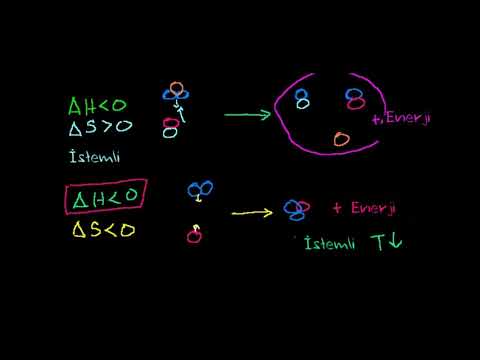
Gibbs serbest enerjisini hesaplayabilmek önemlidir, çünkü onu reaksiyonun ne kadar muhtemel olacağını belirlemek için kullanabilirsiniz. Negatif entalpi ve pozitif entropi ileriye dönük bir reaksiyonu destekler. Pozitif entalpi ve negatif entropi, ilerleyen bir reaksiyonu desteklemez; bu reaksiyonlar, sıcaklıktan bağımsız olarak ters yönde ilerleyecektir. Bir faktör reaksiyonu desteklediğinde diğeri tepki göstermediğinde, sıcaklık reaksiyonun hangi yöne gideceğini belirler. Gibbs serbest enerjisindeki değişiklik negatifse, reaksiyon ilerleyecektir; Pozitif ise tersine gidecektir. Sıfır olduğunda, reaksiyon dengededir.